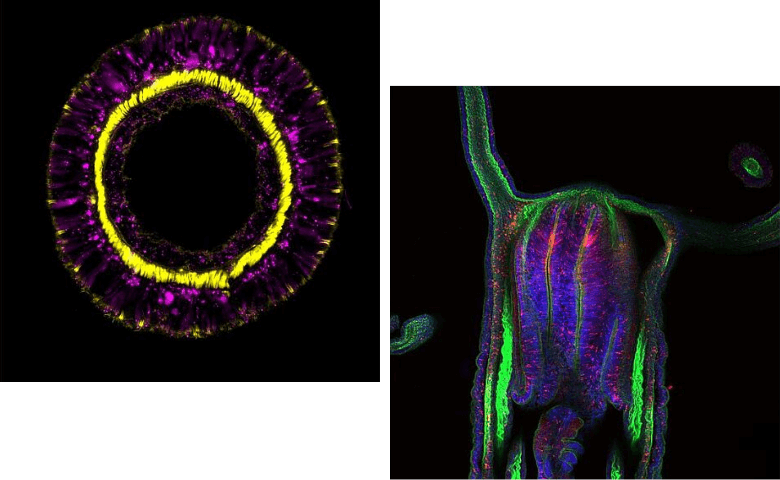
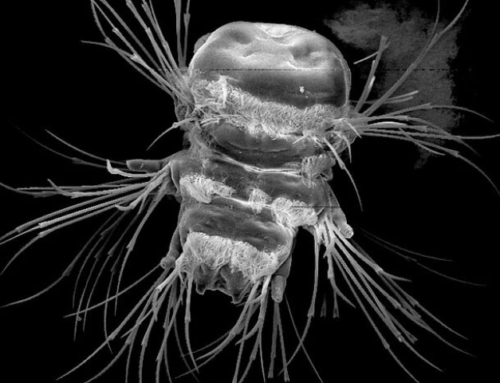
Fast alle tierischen Organismen bestehen aus Millionen von Zellen, die sich in komplexer Weise zu spezifischen Geweben und Organen wie dem Nervensystem gruppieren und aus unzähligen Zelltypen bestehen. Wie dieses wichtige Gleichgewicht von verschiedensten Zelltypen entsteht, wie es reguliert wird, und ob die unterschiedlichen Zelltypen verschiedener tierischer Organismen einen gemeinsamen Ursprung haben ist bislang nicht gut erforscht.
Fingerabdruck von einzelnen Zellen führt zu gemeinsamen Vorfahren
Die Gruppe um den evolutionären Entwicklungsbiologen Ulrich Technau, der auch Leiter der Forschungsplattform Single Cell Regulation of Stem Cells (SinCeReSt) an der Universität Wien ist, hat die Diversität und Entwicklung aller Nerven- und Drüsenzelltypen und ihrer Entwicklungsmechanismen in der der Seeanemone Nematostella vectensis entschlüsselt. Zur Anwendung kam dabei die Methode der Single Cell Transcriptomics, die in den letzten zehn Jahren die Biomedizin und Evolutionsbiologie revolutioniert hat. „Dabei können ganze Organismen in Einzelzellen aufgelöst- und die Gesamtheit aller aktuell exprimierten Gene in jeder einzelnen Zelle entschlüsselt werden. Verschiedene Zelltypen unterscheiden sich merklich durch die exprimierten Gene. Deshalb kann durch Single Cell Transcriptomics der molekulare Fingerabdruck jeder einzelnen Zelle ermittelt werden“, erklärt Julia Steger, Erstautorin der aktuellen Publikation. In der Studie wurden Zellen mit einem überlappenden Fingerabdruck gruppiert. Damit konnten die Wissenschafter*innen definierte Zelltypen oder Übergangsstadien in der Entwicklung unterscheiden, die jeweils einzigartige Expressionskombinationen aufweisen. Das erlaubte den Forscher*innen auch die gemeinsamen Vorläufer- und Stammzellpopulationen der verschiedenen Gewebetypen zu identifizieren. Überraschenderweise fanden sie, dass entgegen früherer Annahmen Nervenzellen, Drüsen- und Nesselzellen aus einer gemeinsamen Vorläuferpopulation stammen, was durch genetische Markierungen in lebenden Tieren verifiziert werden konnte. Da auch bei Wirbeltieren einige Drüsenzellen mit neuronalen Funktionen bekannt sind, könnte dies auf eine evolutionär sehr alte Verwandtschaft von Drüsenzellen und Neuronen hinweisen.
Altbekanntes Gen im Dauereinsatz
Ein Gen spielt bei der Entwicklung dieser Zellen eine besondere Rolle. SoxC ist in allen Vorläuferzellen von Nerven-, Drüsen- und Nesselzellen exprimiert und essentiell für die Bildung all dieser Zelltypen, wie die Autor*innen in knockdown-Experimenten zeigen konnten. Dazu Technau: „Interessanterweise ist dieses Gen kein Unbekannter: Es spielt auch beim Menschen und vielen anderen Tieren eine wichtige Rolle in der Bildung des Nervensystems, was zusammen mit anderen Daten zeigt, dass die wichtigsten regulatorischen Mechanismen der Nervenzelldifferenzierung über das gesamte Tierreich konserviert sind.“ Die Autor*innen fanden zudem durch den Vergleich von verschiedenen Lebensstadien, dass die genetischen Abläufe der Nervenzellentwicklung vom Embryo bis zum adulten Organismus beibehalten werden und damit zum Gleichgewicht der Nervenzellen durch das ganze Leben von Nematostella vectensis beitragen. Dies ist bemerkenswert, weil die Seeanemone im Gegensatz zum Menschen fehlende oder beschädigte Nervenzellen zeitlebens wieder ersetzen können. Für die zukünftige Forschung ergibt sich daraus die Frage, wie die Seeanemone es schafft, diese Mechanismen, die bei komplexeren Lebewesen nur im embryonalen Stadium vorkommen, in kontrollierter Weise bis in den ausgewachsenen Organismus fortzusetzen.
Originalpublikation:
Julia Steger, Alison G. Cole, Andreas Denner, Tatiana Lebedeva, Grigory Genikhovich, Alexander Ries, Robert Reischl, Elisabeth Taudes, Mark Lassnig, and Ulrich Technau. Single cell transcriptomics identifies conserved regulators of neuroglandular lineages. Cell Reports, 2022.